|
|
|
|
|
我所发展聚集体调控探针实现多种细胞器动态超分辨成像 |
|
|
近日,我所分子探针与荧光成像研究组(1818组)徐兆超研究员团队发展了聚集体调控探针,解决了以往蛋白标签荧光探针在超分辨成像应用中缺乏对多种细胞器通用性标记的问题。该探针基于遗传编码技术,实现了细胞内多种细胞器选择性荧光识别的广谱应用性,并且实现了细胞器亚结构的动态超分辨成像,进而揭示了多种未见报道的细胞器结构动态变化,为进一步研究不同细胞器的功能提供工具。
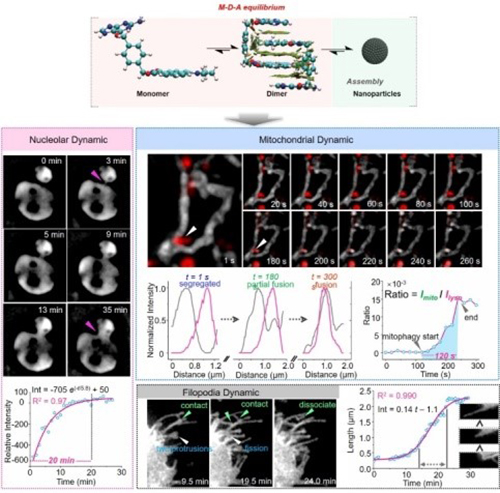
细胞是高度动态的有机体,内部存在多种细胞器,如线粒体、溶酶体、脂滴、内质网、细胞核、细胞膜等。这些细胞器各自发挥不同功能并相互协同,最终通过一系列动态行为完成各种生理活动。因此,纳米尺度下细胞器与亚细胞器动态行为的监测与解析对于生命进程的解密至关重要。徐兆超研究团队前期针对溶酶体内酸性微环境设计合成了溶酶体自闪染料,并借助单分子定位显微镜(SMLM)实时监测了溶酶体运动并发现4种溶酶体间相互作用模式(Angew. Chem. Int. Ed.,2022);针对脂滴内部高度疏水环境设计了缓冲脂滴探针,实现了脂滴的稳定超分辨成像并发现脂滴融合的新模式(Angew. Chem. Int. Ed.,2021)。然而,这些细胞器探针依靠不同细胞器内特有微环境达到对细胞器的定位与识别,单个探针只能实现单一细胞器的标记。有机小分子荧光探针与蛋白标签技术相结合,协同解决了小分子荧光探针靶向性差和荧光蛋白稳定性不足的问题,并且依靠对细胞器中标志蛋白的融合达到对不同细胞器荧光标记和超分辨成像的目的。前期工作中,该团队构建的SNAP蛋白标签探针克服了传统线粒体探针易受电位波动而脱靶的问题,实现了对线粒体的稳定标记和动态超分辨成像(Biosens. Bioelectron.,2021; Angew. Chem. Int. Ed.,2020)。然而,蛋白标签荧光探针依然面临细胞渗透性差的问题,特别是探针在细胞内局域分布使得单一探针难以具有对多种细胞器广谱性标记的性能。
针对此问题,该团队发展了具有“单体—二聚体—聚集体”多体系动态调控的SNAP蛋白标签探针BGAN-Aze,该探针在细胞外形成荧光淬灭的纳米聚集体而具有快速穿透细胞膜和在细胞内广泛分布的能力,在细胞内以单体的形式与目标蛋白共价连接,并伴随荧光的恢复,最终实现细胞内多种细胞器选择性荧光识别与细胞器亚结构的动态超分辨成像。高度平面的萘酰亚胺、苄基与鸟嘌呤能够形成稳定的“卡扣状”荧光淬灭二聚体,大幅降低了荧光成像过程中的背景信号,实现了对SNAP-tag蛋白高的荧光响应倍数(约41倍)。通过质谱、理论计算等,团队验证了体系中二聚体形成的驱动力主要来自于两分子间的范德华力。此外,研究发现BGAN-Aze为不带电荷的中性分子,可保持高度的细胞渗透性与生物相容性,能够实现纳米尺度下对细胞膜、线粒体、细胞核等多种细胞器亚结构的长时间追踪。在已经获得的数据中,典型进展包括丝状伪足的整个生长及相互作用过程,团队进一步揭示了伪足萌芽到成熟过程中每个阶段的速率及时长,丝状伪足的多种形成模式,如融合、分裂、凸起等;监测了线粒体动态行为,揭示了线粒体脊的动态变化,线粒体之间瞬时的相互作用以及线粒体自噬的整个过程;监测了核仁的整个融合过程,揭示了核仁融合的时间速率等。
相关研究成果以“Modulation of Dynamic Aggregation in Fluorogenic SNAP-tag Probes for Long-term Super-resolution Imaging”为题,于近日发表在Aggregate上。该工作的第一作者为我所1818组已毕业博士刘文娟与乔庆龙副研究员,以上研究工作得到国家自然科学基金、所创新基金等项目的资助。(文/图 乔庆龙)
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/agt2.258
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。