西北工业大学李林教授、傅莉教授和西北大学陈希教授等人,结合蛋白质口袋预测与光功能材料设计理念,提出基于蛋白限域荧光效应的“榫卯”二级组装工程(TASE)策略,通过将功能性光敏染料引入白蛋白中组装成光敏蛋白缀合物,有效调控染料激发态释能途径,提高其吸收光子的能量利用效率,实现光转换和激活。相关研究成果发表在Biomaterials上。
临床前研究表明,基于光子学诊疗已成功实现肿瘤光消融,为癌症治疗等再生生物医学应用开辟了新途径,但当前境况仍不尽理想。主要挑战在于大多数相关系统受到多组分设计与合成复杂性、治疗效率低、光活性变化、药物摄取效果及生物安全性等问题的限制;特别是,导致光活性的超快事件的结构基础及其光敏分子构象仍然难以捉摸,电子激发态下光敏药物晶体结构尚未明确。更重要的是,光敏药物缺乏与癌症密切相关的亚细胞定位,极大地阻碍了对其抗肿瘤机制的全面阐释。这些因素共同制约了光敏药物在除特定皮肤病适应症以外的广泛临床应用,尤其是鉴于对纳米颗粒在器官、循环系统及肿瘤间相互作用机制的深层次理解尚待深化,进而阻碍了其作为高效癌症诊疗手段工具的进一步发展。
光敏染料-蛋白缀合物通过“榫卯”结合方式,二次组装成光敏蛋白复合物,使其能够特异性靶向肿瘤组织,并在细胞器中实现精准积累,从而改善光敏药物在患者体内的生物分布和药代动力学,显著降低治疗阈值剂量,最大限度减少副作用并提高治疗效果。研究表明,该光敏蛋白复合物通过PDT效应产生ROS,有效地抑制线粒体活性并损伤肿瘤血管,引发细胞的代谢和氧化应激危机,实现对实体瘤的有效光消融及抗肿瘤转移。
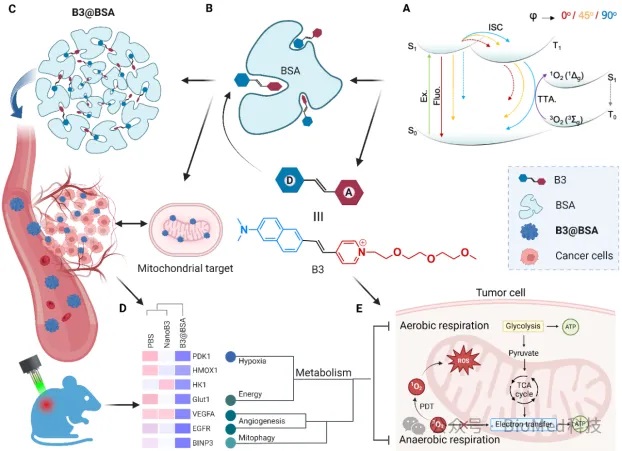 蛋白限域荧光效应二级组装工程(TASE)策略用于线粒体靶向光动力学治疗示意图。(课题组供图)
蛋白限域荧光效应二级组装工程(TASE)策略用于线粒体靶向光动力学治疗示意图。(课题组供图)
?
相关论文信息:https://doi.org/10.1016/j.biomaterials.2024.122914
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:
[email protected]。