中国科学院上海药物研究所研究员李亚平团队,联合上海科技大学研究员张鹏程团队、中国科学院福建物质结构研究所研究员张璐团队,发现了纳米丝(PFs)与蛋白的独特作用模式,揭示了多肽的二级结构可调控其非特异性蛋白吸附,进而改变纳米丝生物命运的机制。11月28日,相关研究发表于《先进材料》。
通过自组装形成各种不同形状的生物结构在自然界中广泛存在。其中,以微管和胶原蛋白为代表的生物纳米纤维,即PFs,可凭借其多价结合等特性,形成独特的生物学功能。然而,目前PFs与蛋白质多价相互作用的机制尚未被阐明。
研究团队以羧基端带组氨酸-赖氨酸-天冬氨酸(HKD)的棕榈酰化β-折叠形成序列C16-GVVQQHKD(P1)这一两亲性多肽分子为母体,在P1序列基础上分别插入四聚甘氨酸、四聚丝氨酸、四聚脯氨酸、四聚羟脯氨酸以形成不同的两亲性多肽分子(P2-P5),并自组装形成不同的PFs(P1Fs-P5Fs)。通过改变同源四肽,研究人员在PFs内施加了不同的构象,导致主链分子间氢键密度存在显著差异,从而改变了PFs的蛋白吸附量。吸附的蛋白质则可以进一步诱导不同程度和模式的PFs丝间缠结,影响生物分布等体内行为。
值得一提的是,主链分子间氢键密度最低、二级结构β-折叠含量最低的P5Fs表现出最少的非特异性蛋白吸附和最小的纤维间缠结。在体内,P5Fs具有长血液循环、低肝脏清除的提点,可有效提高物理包埋或化学偶联药物的抗肿瘤效果。
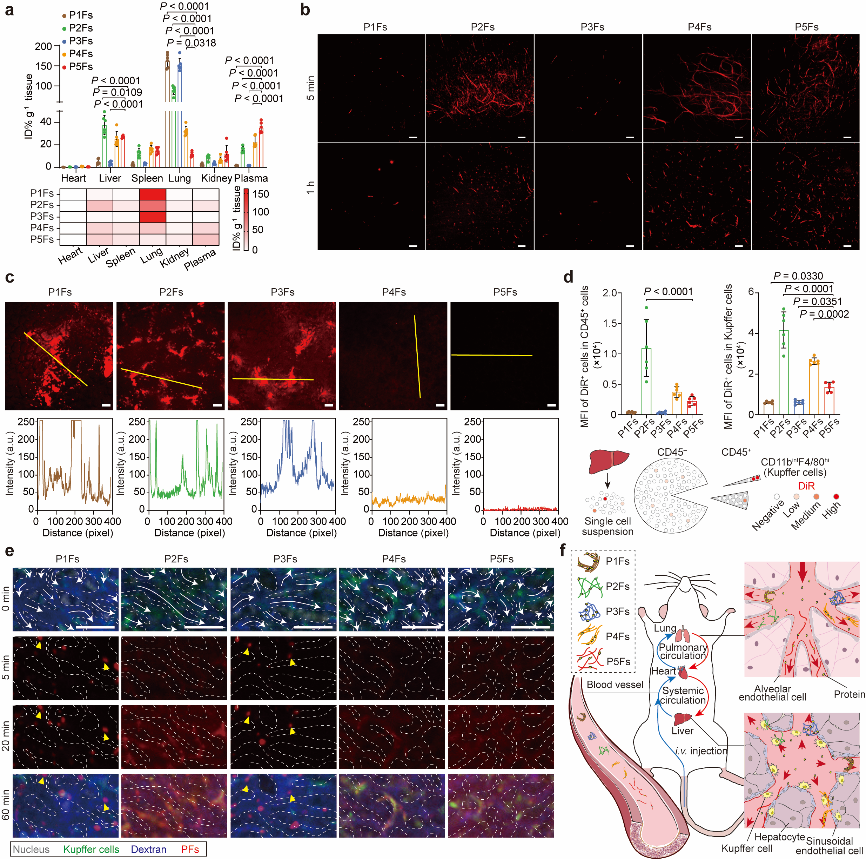 不同PFs的体内生物学行为。图片来源于《先进材料》
不同PFs的体内生物学行为。图片来源于《先进材料》
?
相关论文信息:https://doi.org/10.1002/adma.202409130
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:
[email protected]。