|
|
|
|
|
“双爸”鼠宝,创纪录活到“成年” |
|
中国科学家历时七载解锁哺乳动物单性生殖密码 |
两个鼠爸也能生出一只鼠宝?这并非天方夜谭。
1月29日,正值新春佳节之际,一项发表在国际权威学术期刊《细胞-干细胞》的研究宣布了这一科学成果。中国科学院院士、中国科学院动物研究所研究员周琪,携手该所研究员李伟、副研究员李治琨以及中山大学教授骆观正等,利用胚胎干细胞工程技术,成功培育出只有两个鼠爸的小鼠,而且创纪录地活到了成年。
这项突破性进展一经发布,就引起国际学术界的广泛关注,被认为克服了哺乳动物单性生殖中前所未有的挑战。
 成年的孤雄小鼠(左)和同龄、同性别的野生型对照小鼠。中国科学院动物研究所供图
成年的孤雄小鼠(左)和同龄、同性别的野生型对照小鼠。中国科学院动物研究所供图
?
从不可能到可能
欢快踱步的家鸡、翱翔天际的秃鹫、威风凛凛的科莫多巨蜥,甚至是池塘里咕呱鸣叫的蛙类,这些人们所熟知的动物都能孤雌生殖——在没有爸爸的情况下孕育新生命。这听起来是不是既神奇又有趣?
但在哺乳动物的世界里,孤雌生殖或单性生殖现象却从未被观察到。长久以来,哺乳动物都遵循着受精卵发育的法则:精子与卵子的结合是不可或缺的环节,爸爸和妈妈一个都不能少。
两个精子或者两个卵子能够诞生出完整的宝宝吗?
科学界一度认为这是不可能的。从20世纪80年代起,科学家们就踏上了哺乳动物单性生殖研究的征途。但最初的尝试却令人沮丧,尽管他们能够培育出全母源胚胎,但一旦将其移植到母体子宫,就像被施了魔咒,无一例外地停止发育,最终胎死腹中。
直到20世纪90年代初,富于探索的科学家们才找到了这一问题背后的关键——印记基因。“普通基因平等地表达父母双方的遗传信息,而印记基因却很‘任性’,只从父本或母本一方表达,另一方则默默‘隐身’。”该论文通讯作者李伟对《中国科学报》说。
这一独特机制让哺乳动物的两套基因组不再相同,后代的正常发育离不开父母双方完整的遗传信息。这似乎也为哺乳动物无法进行孤雌生殖给出了合理答案:印记基因凭借独特的表达方式,关上了单亲繁殖的大门。
科学家们希望重新打开这扇门。2004年,日本东京农业大学科学家Tomohiro Kono团队通过精准修改关键印记基因H19的调控区,首次成功培育出“有两个妈妈”的孤雌小鼠,这些小鼠不仅存活至成年,还展现了令人惊奇的特性——虽然体重远低于正常小鼠,但寿命却比普通小鼠长了28%!
“双妈”鼠宝的发育异常是什么引起的?为了揭开这一问题的面纱,科学界把目光转向了孤雌生殖的对立面——孤雄生殖。事实上,自然界脊椎动物中至今也未发现纯雄性繁殖的真实案例,这使得孤雄生殖更像是存在于理论中的奇妙构想。
“这背后有着深层次的生物学原因。”该论文研究第一兼通讯作者李治琨向《中国科学报》解释说,“卵子不仅提供遗传物质,还为胚胎发育初期提供所有必需物质,蛋白质、RNA、初始细胞器等,这些复杂的分子机器是生命起始的关键。而精子只是微小的遗传信息载体,缺乏‘启动工具’,无法独自支撑胚胎正常发育。”
2011年,美国得克萨斯大学研究团队从雄性小鼠体内获取干细胞,在培养过程中使其部分丢失了Y染色体变成“雌性”干细胞,基于此培育出具有双父本遗传信息的小鼠。这证实了孤雄生殖的可能性,但并未解决更深层的遗传调控问题。
真正的突破是在2018年,周琪、李伟和胡宝洋等中国科学家不仅创造出能够健康长大并繁衍后代的“双妈”小鼠,还将小鼠精子注入去核卵细胞,创造出“纯雄性”受精卵,并首次诞生了存活48小时的“双爸”鼠宝。
这项研究不仅证实了孤雄生殖的可能性,更为印记基因编辑打开了新的篇章。但奇迹背后,科研人员的心中仍然存在着遗憾与困惑:“双爸”小鼠的外形和正常小鼠截然不同,倒像一只奇怪的“小海象”,体长只有约三厘米,身体胖乎乎的,四肢短小,浮肿严重,无法正常呼吸和活动。短时间内就不幸死亡也让人难过。
这一结果再次证明,哺乳动物的孤雄生殖比孤雌生殖更难实现。但研究团队并未就此止步。
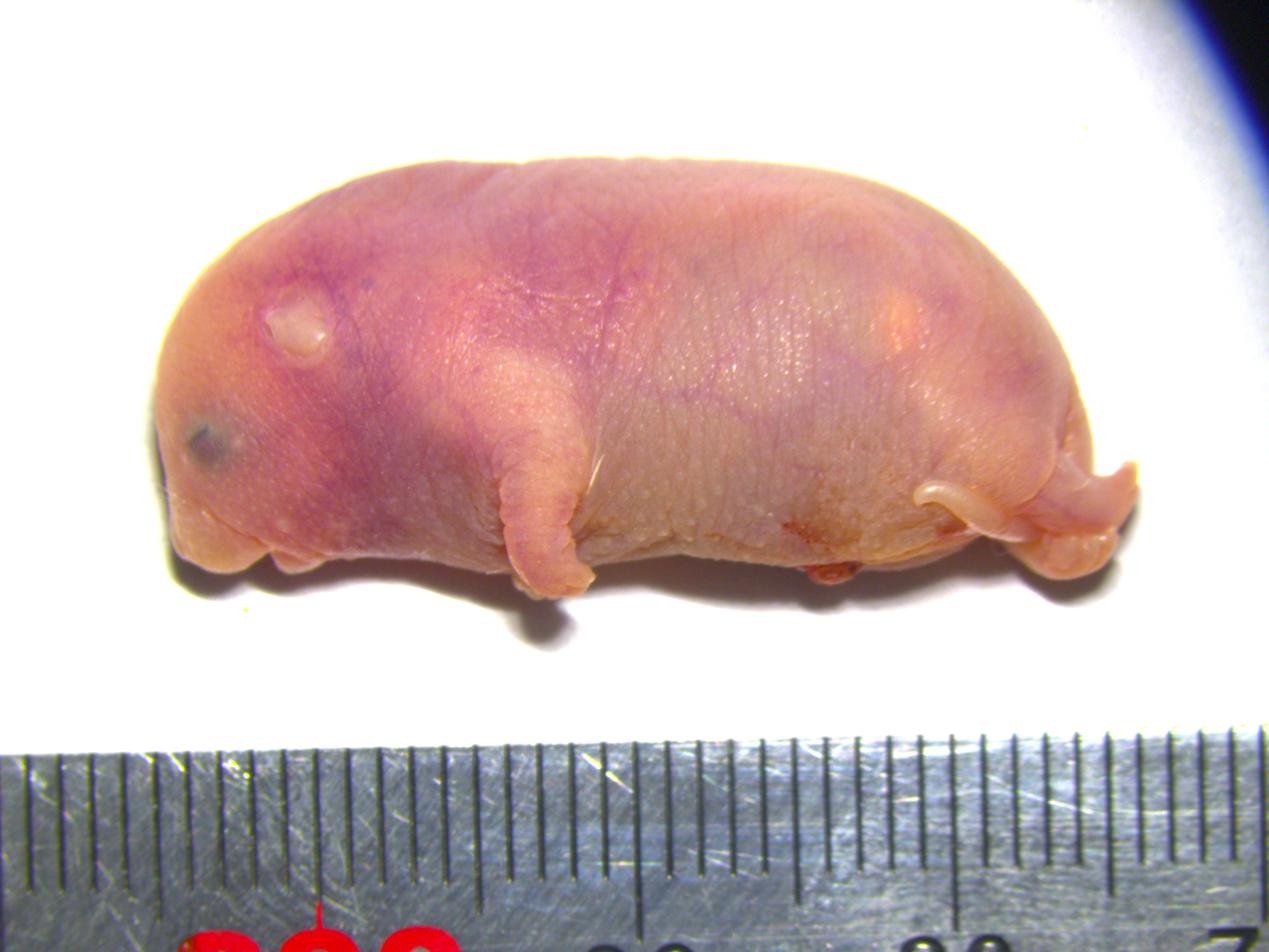 携带六个关键印记基因区段修复的孤雄小鼠。中国科学院动物研究所供图
携带六个关键印记基因区段修复的孤雄小鼠。中国科学院动物研究所供图
?
突破“双爸”鼠宝发育瓶颈
“双爸”鼠宝发育缺陷背后,还有哪些未解之谜?
研究团队在追本溯源的过程中发现,多个印记基因与孤雄胚胎的发育问题紧密相关。特别是当父源DNA异常二倍化时,这些印记基因区域就像是路上的绊脚石,会阻碍胚胎的正常发育。已知的这些印记区域包括Nespas、Igf2r、Kcnq1、Peg3、Snrpn和Grb10等。
就像修补破损的拼图一样,研究团队在孤雄单倍体胚胎干细胞中逐一修复这些印记区域,再将经过基因编辑的胚胎干细胞与另一枚精子共同注入去核卵细胞。然而,即便如此,“小海象”的出现说明孤雄胚胎的发育瓶颈依旧未能被彻底突破。
这究竟是怎么回事呢?他们对孤雄小鼠进行了解剖,结果令人震惊:这些小鼠的水肿不仅出现在体表,还蔓延到了内脏器官,导致部分器官显著肿大,肝脏甚至比正常小鼠大了5倍!这一异常现象让他们提出了一个大胆的假设:孤雄小鼠的死亡,或许是因为内脏器官过度膨胀,压迫了胸腔和其他器官,影响了正常的生理功能。
基于这一假设,研究团队决定进行第二轮基因编辑,目标不仅是修复导致胚胎死亡的印记基因,还扩展到所有可能与胚胎过度生长相关的区域。经过先后五轮对19个不同印记区段进行基因编辑,他们终于看到了希望的曙光:孤雄小鼠的体重逐渐下降,内脏器官肿大和水肿等异常症状开始缓解,最终约30%的孤雄小鼠成功存活至成年!
然而,这只是踢开了孤雄生殖道路上的一块绊脚石。要实现完整的孤雄生殖,还有一个重要挑战——胎盘。由于孤雄胚胎无法发育出正常胎盘,他们就巧妙地运用“四倍体补偿”技术,为胚胎发育提供了所需的胎盘组织。通过进一步修复孤雄胎盘中一些印记基因的异常表达,他们终于成功构建了携带20个印记区段基因编辑的孤雄单倍体胚胎干细胞,并将其与精子共同注入去核卵细胞,成功转化为可存活的胎儿和功能完整的胎盘。
“通过这种方式构建的孤雄小鼠,与普通小鼠有着显著的不同。它们的体重增长迅速,当普通小鼠体重达到20克时,孤雄小鼠的体重大约已达30克。而且,孤雄小鼠还表现出更强的探索欲,在旷场实验中频繁进入中心区域,这与啮齿类动物习惯沿边缘活动的习性大相径庭。”李治琨说。
有趣的是,孤雌小鼠不仅体重增长模式与孤雄小鼠相反,行为上也形成了鲜明的对比。在旷场实验中,孤雌小鼠几乎总是沿着边缘活动,很少进入中心区域。这种孤雄与孤雌小鼠行为上的“镜像”现象,令人惊叹不已。
此外,它们的寿命也有明显差异。孤雌小鼠寿命较长,而孤雄小鼠的寿命仅为普通小鼠的60%。对孤雌和孤雄小鼠的DNA甲基化检测发现,孤雌小鼠印记基因的甲基化特征与卵子的甲基化模式高度相似,而孤雄小鼠则FC碰碰胡老虎机法典-提高赢钱机率的下注技巧保留了精子的甲基化特征。这一发现不仅在大脑、小脑和多种内脏器官的甲基化检测中得到了验证,也为理解它们在体重、行为和寿命上的差异提供了新线索。这些差异很可能源于它们体内未完全修复的残余基因印记。
“这些发现提供了强有力的证据,表明印记异常是哺乳动物单性繁殖的主要障碍。”论文共同通讯作者骆观正说,“这种方法可以显著改善胚胎干细胞和克隆动物的发育结果,为再生医学发展开拓了一条充满希望的道路。”
改写印记基因认知
“双爸”鼠宝研究,为揭开印记基因在单性生殖障碍中所扮演的复杂角色,提供新的视角。
研究表明,印记基因的演化目标并非直接阻止单性生殖,而是与单性生殖存在间接联系,可调控胚胎发育过程中的资源分配和空间适应,来间接影响单性生殖的成功率。
李伟表示,“双爸”小鼠研究表明,印记基因调控着母源与父源基因的相互作用,影响胚胎发育,间接决定了孤雄或孤雌小鼠的诞生。“这一过程符合经典的冲突假说——印记基因的演化和生殖障碍没有直接关联,而是通过调控胚胎在母体子宫内的发育,帮助胎儿适应有限空间。”他说,“母源印记基因倾向于‘缩小’胎儿体积,以适应有限的子宫空间;父源印记基因则通过‘增大’胎儿体积,提高后代生存几率。”
“孤雄与孤雌小鼠在体重、行为和寿命上的镜像差异,正是父母基因博弈的副产品。”他补充说,这也为探索基因与环境适应的复杂关系提供了宝贵线索。
李治琨也表示,当体内有两套父本DNA时,胚胎往往会过度生长,这种生物学上的不可持续性最终会影响其存活。这些异常虽然单独看来并不致命,但一旦得到修复,却能产生可存活的个体。这些都表明,印记基因的并不只是单单直接阻止单性生殖。
不过,研究人员指出,这项研究仍面临诸多挑战。例如,目前仅11.8%的存活胚胎能够发育到出生,并非所有幼崽都能存活至成年,而且大多数活到成年的小鼠都寿命缩短,且是不育的。“仍需要通过进一步优化印记基因的修饰方案,培育出更健康的双父亲小鼠,最终为印记相关疾病带来新的治疗策略。”李治琨说。
下一步,该团队将继续研究如何通过修饰印记基因来产生具有更高发育潜能的胚胎。他们还计划将这些在小鼠中开发的实验方法扩展到猴子等更大的动物模型中。不过,这将需要相当多的时间和努力,因为猴子的印记基因组合与小鼠有很大的不同。
值得注意的是,虽然该技术展示了巨大的潜力,但在应用于人类之前还需克服许多伦理和技术障碍。当前,国际干细胞研究学会的伦理指南禁止将此类技术用于人类生殖目的,认为其安全性尚未得到充分验证。
随着技术的进步,未来某一天或有望看到相关的医学应用。
相关论文信息:http://doi.org/10.1016/j.stem.2025.01.005
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:
[email protected]。