|
|
|
|
|
揭示先锋转录因子在细胞凋亡表观遗传中的关键作用 | Cell Research |
|
|
论文标题:Pioneering function of Isl1 in the epigenetic control of cardiomyocyte cell fate
期刊:Cell Research
作者:Rui Gao, Xingqun Liang, Sirisha Cheedipudi, Julio Cordero, Xue Jiang, Qingquan Zhang, Luca Caputo, Stefan Günther, Carsten Kuenne, Yonggang Ren, Shoumo Bhattacharya, Xuejun Yuan, Guillermo Barreto, Yihan Chen, Thomas Braun, Sylvia M. Evans, Yunfu Sun, Gergana Dobreva
发表时间:2019/04/25
数字识别码: 10.1038/s41422-019-0168-1
原文链接:http://t.cn/EKljgTi
微信链接:https://mp.weixin.qq.com/s/sneIJJuGWsIcJ9oXFLlI4A
研究揭示Isl1 / Brg1-Baf60c复合物在协调心脏发生和建立心肌细胞命运的表观遗传记忆中起着至关重要的作用
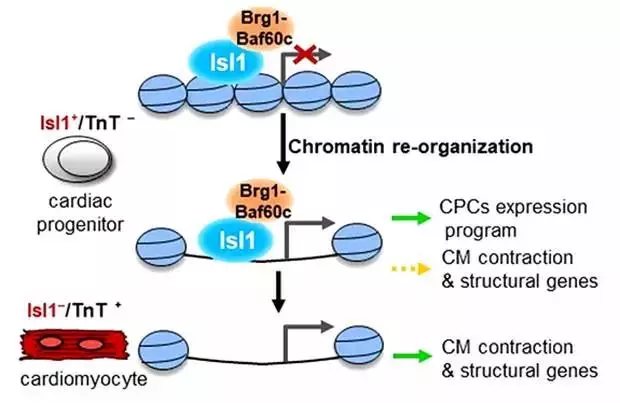
图1
从单个全能受精卵产生广泛不同和特化的细胞类型涉及大规模转录变化和染色质重组。先锋转录因子在编程表观基因组中起关键作用,并在连续细胞谱系规范和分化步骤中促进其他调节因子的募集。
2019年4月25号,同济大学心律失常教育部重点实验室、同济大学附属东方医院课题组长孙云甫教授、梁兴群教授团队等在Cell Research上在线发表了题为“Pioneering function of Isl1 in the epigenetic control of cardiomyocyte cell fate”的研究论文。该研究揭示Isl1 / Brg1-Baf60c复合物在协调心脏发生和建立心肌细胞命运的表观遗传记忆中起着至关重要的作用。
干细胞/祖细胞分化为不同的谱系涉及到一系列大规模的转录变化和染色质重组。组织特异性转录因子与表观遗传修饰因子协同作用对表观基因组进行编程,建立细胞同一性,这是由表观遗传调控机制进一步维持的。为了启动细胞程序设计,一种特殊类型的转录因子,即先锋转录因子,将发育沉默的基因嵌入在细胞核覆盖的“封闭”染色质中。先锋因子本身不足以激活基因,但它赋予染色质开放转录的能力。染色质开放有助于随后招募额外的转录因子和其他调节蛋白,这些蛋白协同工作,在谱系说明和心脏发生过程中的一系列步骤中诱导细胞类型特异性基因表达程序,多个转录因子相互配合,并整合在调控网络中,这些网络严格控制着确保心脏正常发育的转录程序。
Isl 1是一种LIM-同源结构域转录因子,在分化和整合到心脏管之前,在SHF祖细胞中瞬时表达。这些细胞被添加到心脏管的动脉和静脉极,从而使其持续生长,并形成复杂的形态发生模式SHF心脏祖细胞(CPCs)的部署和分化在很大程度上是造成人类先天性心脏畸形的主要原因,这凸显了更全面地了解SHF介导的心脏发育的机制的重要性。从小鼠的遗传学研究可以看出,Isl 1在SHF发展中的关键作用,表明Isl 1缺陷小鼠胚胎缺乏从SHF中提取的所有结构,包括右心室(RV)、流出道(OFT)和大部分心房,因为Isl 1是SHF CPC的增殖、存活、迁移及其分化为不同心脏线的必要条件。最近的研究发现Isl 1变异体和缺失与先天性心脏病有关。尽管Isl 1在心脏发育和疾病中起着关键作用,但对其分子作用模式的详细见解却严重缺失。
在这里,研究显示Isl1通过塑造心脏祖细胞的染色质景观,作为驱动心肌细胞谱系的先驱因素。使用显示先天性心脏缺陷的Isl1亚型小鼠系列,Isl1结合的基因组范围分析以及心脏祖细胞及其衍生物的RNA-和ATAC-测序,揭示了Isl1下游的调节网络,其协调心脏发生。在机制上,研究显示Isl1与压缩的染色质结合并与基于Brg1-Baf60c的SWI / SNF复合物协同工作,以促进染色质景观中允许的心脏谱系特异性改变,不仅是在心脏祖细胞中具有关键功能的基因,而且还有当Isl1本身不再存在时高度表达的心肌细胞结构基因。因此,Isl1 / Brg1-Baf60c复合物在协调心脏发生和建立心肌细胞命运的表观遗传记忆中起着至关重要的作用。
马克斯普朗克心肺研究所Gergana Dobreva教授和加州大学圣地亚哥分校Sylvia M. Evans教授共同合作完成该研究。
摘要:Generation of widely differing and specialized cell types from a single totipotent zygote involves large-scale transcriptional changes and chromatin reorganization. Pioneer transcription factors play key roles in programming the epigenome and facilitating recruitment of additional regulatory factors during successive cell lineage specification and differentiation steps. Here we show that Isl1 acts as a pioneer factor driving cardiomyocyte lineage commitment by shaping the chromatin landscape of cardiac progenitor cells. Using an Isl1 hypomorphic mouse line which shows congenital heart defects, genome-wide profiling of Isl1 binding together with RNA- and ATAC-sequencing of cardiac progenitor cells and their derivatives, we uncover a regulatory network downstream of Isl1 that orchestrates cardiogenesis. Mechanistically, we show that Isl1 binds to compacted chromatin and works in concert with the Brg1-Baf60c-based SWI/SNF complex to promote permissive cardiac lineage-specific alterations in the chromatin landscape not only of genes with critical functions in cardiac progenitor cells, but also of cardiomyocyte structural genes that are highly expressed when Isl1 itself is no longer present. Thus, the Isl1/Brg1-Baf60c complex plays a crucial role in orchestrating proper cardiogenesis and in establishing epigenetic memory of cardiomyocyte fate commitment.
阅读论文全文请访问:http://t.cn/EKljgTi
期刊介绍:The Cell Research (CR) publishes original research results that are of unusual significance or broad conceptual or technical advances in all areas of life sciences, as long as the study is closely related to molecular and cell biology. Please go to Aims and scope page for more details.
(来源:科学网)
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。