|
|
|
|
|
聚酮合酶脱水双模块结构域共同催化形成Z型双键作用机制 |
|
|
2021年7月4日,《德国应用化学》(Angewandte Chemie International Edition)在线发表了武汉大学药学院孙宇辉教授课题组和德国波恩大学Jeroen S. Dickschat教授课题组在聚酮合酶(Polyketide synthase, PKS)生物合成领域最新研究进展,题为“The Mechanism of Dehydrating Bimodules in trans-Acyltransferase Polyketide Biosynthesis: A Showcase Study on Hepatoprotective Hangtaimycin”,揭示了PKS中A型脱水双模块结构域共同催化形成Z型双键的作用机制。
肝脏是人体内以代谢功能为主的一个重要器官。而生活中许多原因都容易导致肝损伤,现代快节奏的生活也加剧了肝损伤的发生,肝损伤后期极易发展成为肝硬化及肝癌,严重威胁人类健康。然而,目前临床抗肝损伤药物较少,开发新的抗肝损伤药物成为治疗肝损伤的迫切需求。
孙宇辉教授课题组前期在微生物活性天然产物的挖掘过程中,从武汉大学校园土壤中分离到的一株链霉菌(Streptomyces spectabilis CCTCC M2017417)中发现了一类具有抗耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)活性的萘安莎类抗生素——曲张链丝菌素(Streptovaricins),并对参与曲张链丝菌素的多个细胞色素P450酶编码基因进行了全面探索(ACS Chemical Biology, 2017, 12: 2589-2597),揭示了与其中亚甲基双氧桥结构相关的生物合成机制(Nature Communications, 2020, 11: 4501)。
在对这一菌株活性次生代谢产物的进一步挖掘过程中,重新分离获得了媲美一线抗肝损伤临床药物水飞蓟素(Silymarin)的活性先导化合物Hangtaimycin(图1),并纠正了其立体化学构型。通过对Hangtaimycin的结构及其生物合成基因簇生物信息学分析,发现Hangtaimycin的碳骨架化学结构与催化其生物合成的PKS结构域(Domain)功能之间存在非经典线性对应,其中HtmA1中四个模块(Module)仅负责催化两轮碳链延伸(图1)。
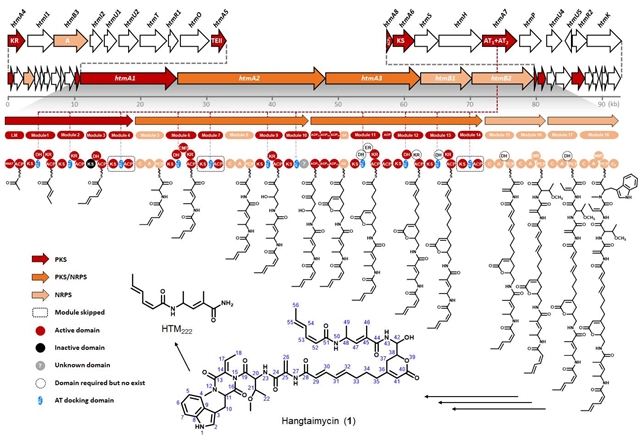
图1、Hangtaimycin生物合成模型
根据Hangtaimycin的化合物结构及模块中各个结构域的组成,提出了四个可能的模型(图2)。为了检验模型,首先对HtmA1模块1中的酮基还原酶结构域KR1和脱水酶结构域DH1进行了定点突变。两个突变株除了终止Hangtaimycin和Hangtaimycin的末端环二肽化合物色氨酸-脱氢丁酸二酮哌嗪(Tryptophan-dehydrobutyrine diketopiperazine, TDD)的生物合成外,并未生成对应的中间体。进一步突变HtmA1模块3中的DH3和模块2中的KR2结构域,虽然也没获得相应中间体,但它们也都终止了Hangtaimycin和TDD的产生,证明DH3和KR2结构域都参与了Hangtaimycin的生物合成。结合模块2和模块3中结构域的组成和排列顺序(模块2:KS2-ATd-KR2-ACP2;模块3:KS3-DH3-ACP3),暗示模块2和3可能共同合作完成一轮二碳单元的延伸。KS3中保守催化三联体Cys-Asn-His的突变,表明KS3可能无催化失活,同时,KR2没有LDD保守基序(Motif),暗示它可能是第二个Z型双键形成的原因。通过进一步对ACP2、KS3、ACP3进行点突变,所有这些突变株都终止了Hangtaimycin和TDD的产生,表明模块2可能是在催化延伸引入一个β-OH二碳单元后,聚酮链中间体转移到模块3,通过DH3脱水作用,最后形成第二个双键。
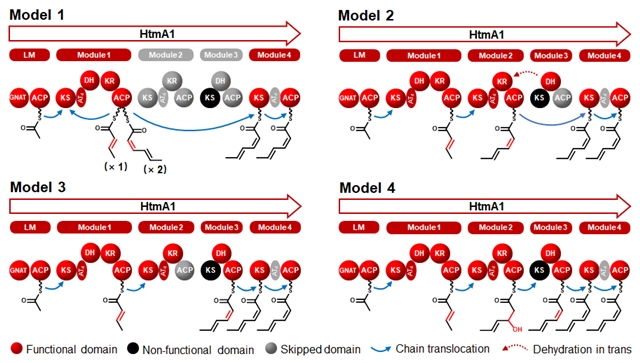
图2、HtmA1催化三酮中间体合成模型
为了进一步验证HtmA1的催化模型,化学合成了第二轮延伸的模拟底物进行模块1、2和3的体外催化(图3)。运用体内遗传失活、底物化学合成及体外生化重建等方法,最终证明了模块1仅负责一个不饱和双键单元的延伸,模块2模块3以非典型共线性脱水双模块的方式,共同催化第二个Z型双键的形成(图4)。

图3、HtmA1催化三酮中间体合成的体外重建
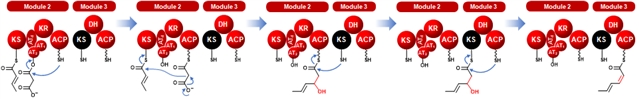
图4、HtmA1中脱水双模块结构域共同催化形成Z型双键作用机制
在经典的I型PKS催化聚酮碳链骨架生物合成过程中,PKS模块和结构域的数量和功能与其所催化形成的相应化学结构之间存在着严格的线性对应关系,即聚酮链合成的底物选择、还原程度和产物的立体化学构型都是由PKS上相应模块中的结构域所决定,通过对酮基选择性地还原和脱水,从而在终产物的相应位置形成酮基、羟基、双键等功能团,同时还可决定产物手性中心的立体化学构型。尽管之前在PKS中已发现脱水双模块之间可以合作的方式共同催化一个双键的形成,但是本研究首次证实了这一脱水双模块的作用方式和机制。这一发现有助于进一步拓展人们对PKS经典的线性装配模式的认知,也为聚酮药物的人工创新提供新的契机和灵感。
该研究得到国家重点研发计划的支持。(来源:科学网)
相关论文信息:https://doi.org/10.1002/anie.202106250
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。