|
|
|
|
|
SpDIR1L,一种参与番茄进化枝S-RNase 独立的花粉排斥的蛋白质 | MDPI IJMS |
|
|
论文标题:A Cysteine-Rich Protein, SpDIR1L, Implicated in S-RNase-Independent Pollen Rejection in the Tomato (Solanum Section Lycopersicon) Clade(SpDIR1L,一种参与番茄进化枝S-RNase 独立的花粉排斥的蛋白质)
期刊:IJMS
作者:Juan Vicente Muñoz-Sanz et al.
发表时间:2 December 2021
DOI:10.3390/ijms222313067
微信链接:
https://mp.weixin.qq.com/s?__biz=MzI1MzEzNjgxMQ==&mid=2650047098&idx=3&sn=
5cacfcc7107e05d928014b04b2b04cb5&chksm=f1d938bec6aeb1a8619d90ebe9b2da63
41c5c3fab38adc4add7291ba135f6bf49785609b80da&token=218529226&lang=zh_CN#rd
期刊链接:
https://www.mdpi.com/journal/ijms
研究背景
种间生殖障碍 (IRBs) 对物种形成以及植物进化中种间杂交具有重要意义[1,2],目前针对IRBs机制的研究越来越多,鉴定出大多数的IRBs都是活性系统,即特定的屏障基因在雌蕊中表达,而相容的同种花粉必须表达适当的抗性,学者们称之为屏障结构[3–5]。
番茄进化枝在阐明S-RNase依赖和S-RNase独立的IRBs方面都具有优势。番茄枝属植物 (Solanum sect. Lycopersicon),其种间自交不亲和 (SI) 受S-Locus复等位基因控制,其特征是雌蕊的自交不亲和基因编码一个分泌型的RNA酶 (S-RNase),花粉的自交不亲和基因编码一个F-box蛋白 (S-locus F-box, SLF),S-RNase的表达受发育控制,而不是对授粉的响应,因此其细胞毒活性对没有抗性机制的花粉构成组成性屏障[4–6]。而花粉表达的S位点F-box (SLF) 蛋白可以提供抗性。值得注意的是番茄枝属植物中IRBs的SCxSC单侧不亲和 (UI) 的存在,为鉴定S-Rnase独立的IRBs形成因素提供机会。
来自美国密苏里大学胡安·维森特·穆尼奥斯·桑斯教授及其他学者在International Journal of Molecular Sciences (IJMS) 期刊发表文章“A Cysteine-Rich Protein, SpDIR1L, Implicated in S-RNase-Independent Pollen Rejection in the Tomato (Solanum Section Lycopersicon) Clade”,文中作者利用S. pennellii LA0716的IRBs发育谱作为一种识别候选障碍基因的手段,在8个候选基因中构建CRISPR/Cas9突变体,评估突变体对番茄花粉管生长的影响。研究人员发现,SpDIR1L蛋白积累与IRB强度相关,且对S. lycopersicum花粉具有弱IRB或无IRB的物种在SpDIR1L上游区域存在150bp的缺失。随后的实验结果表明SpDIR1L参与了S-RNase独立的IRBs,但DIR1L依赖的花粉排斥机制仍有待进一步研究。
结果与分析
1. 候选基因和CRISPR/Cas9突变体
为了更好地理解SC S. pennellii LA0716 × S. lycopersicum的IRBs,研究者对8个候选的雌蕊侧屏障基因进行了评估。利用CRISPR/Cas9技术在每个候选基因中创建突变,并对这8个T0代突变体进行自交,鉴定了多达三个纯合品系用于测试授粉表型,产生的18个突变等位基因用于评估S. lycopersicum花粉管生长的变化 (表1)。
表1. 在选定的候选雌蕊侧基因中产生了CRISPR/cas9靶向突变
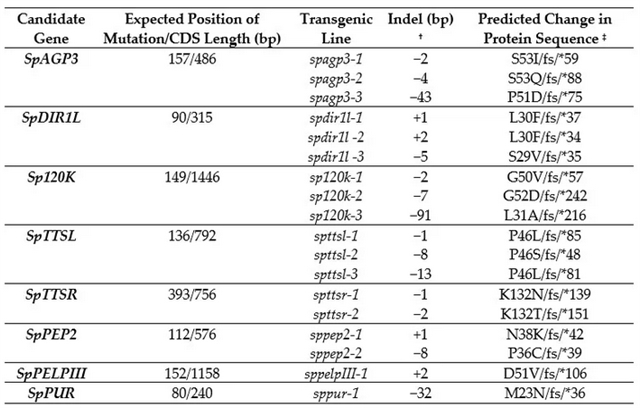
表注: † "−" :deletion; "+" :insertion. ‡ 氨基酸改变和突变的位置/类型 (fs,移码);* 终止密码子从预测蛋白质的起始密码子引入计数。
2. 鉴定IRB屏障基因—SpDIR1L
图1-3总结了8个候选基因功能缺失突变体的种间授粉结果。由于花粉管的排斥并不同步,所以研究者用两个指标来描述IRBs (以长度的百分比表示大多数花粉管停止点以及单个花粉管最长停止点)。在8个被测基因中,SpPEP2、SpAGP3、SpPUR、SpTTSL、SpTTSR、Sp120K和SpPELPIII的结果不支持它们在IRB中起作用,与对照组相比,SpPUR突变体中虽有少量番茄花粉管深入花柱,但大部分花粉管并未受影响。只有SpDIR1L具有S. pennellii LA0716×S. lycopersicum屏障基因的特征,与对照组相比,SpDIR1L突变使大多数番茄花粉管向花柱内移动近50% (突变体和对照分别为42%和24%,图3b)。最长花粉管所反映的表型更为显著,花粉管进入花柱下方三分之一处,有时达到花柱长度的95% (图3c) 。在未转换的对照组中从未观察到此现象,因此,研究者推断SpDIR1L参与了番茄花粉排斥。
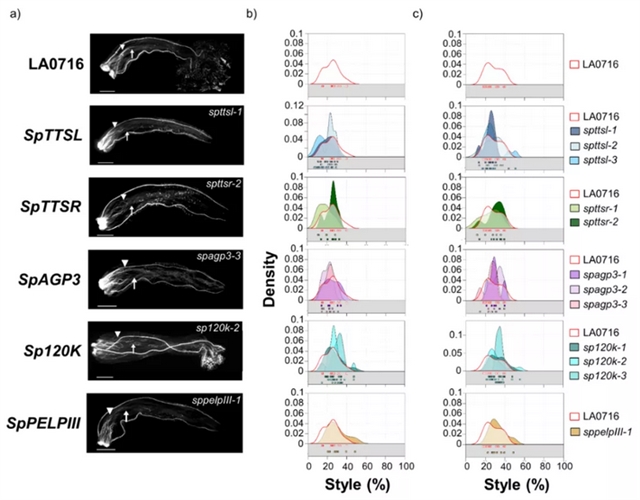
图1. CRISPR/Cas9功能缺失突变体的IRB表型与对照无显著差异。
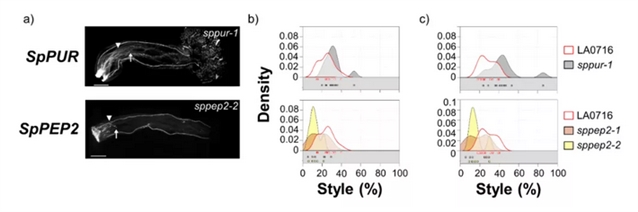
图2. CRISPR/Cas9功能缺失突变体的IRB表型与对照有显著差异,但不具有IRB基因屏障功能。
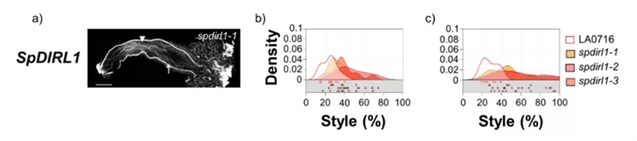
图3. CRISPR/Cas9功能缺失突变体的IRB表型与对照有显著差异,具有IRB基因屏障功能。(a) S. pennellii LA0716对照 (第一排) 和8个突变体的花粉管。将纯合突变体去雄,次日用番茄花粉授粉,48h后成像,显示突变体的特异等位基因。三角形,大多数花粉管停止的位置;箭头,可见的最长花粉管;(b) 和 (c):核密度图显示了大多数花粉管 (b) 或最长可见花粉管 (c) 被捕获的位置,以花柱横贯的百分比表示 (x轴)。未转换的对照数据显示在每个图中,以方便直接比较。每个核密度图下面的方块表示用于绘制核分布的授粉。
3. DIR1L 基因在具有强IRB物种中表达
图4a (左) 显示了一个简化的番茄进化谱系,该进化枝主要被分为4个类群:Esculentum (including S. lycopersicum), Arcanum, Peruvianum, and Hirsutum (including S. pennellii)[7,8]。基因组数据和蛋白质印迹分析结果表明,番茄分枝中DIR1L基因表达与IRB强度之间存在广泛的相关性,单独DIR1L蛋白不足以对番茄孢粉产生排斥反应,且增加屏障强度是由于多个具有累加效应的屏障,而不是单个更有效的屏障[3,4,9]。
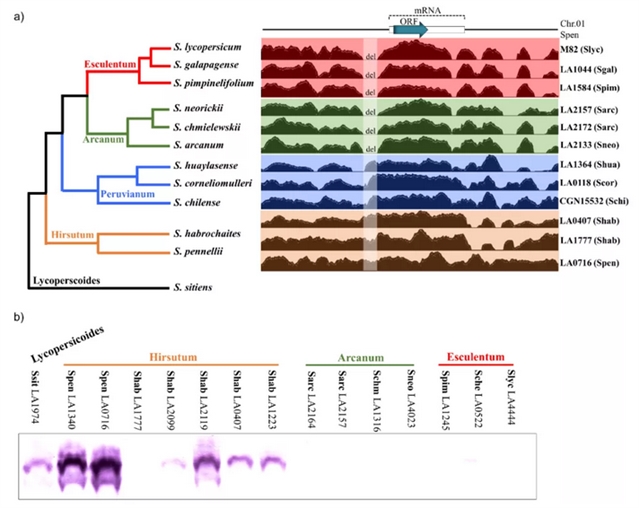
图4. 番茄进化枝中DIR1L的表达。(a) 左图,简化的番茄分支系统发育显示Esculentum, Arcanum, Peruvianum和Hirsutum亚群。树的结构和分支长度基于[9,10]。右图,短读每个亚群的代表性材料的基因组数据,这些数据被映射到S. pennellii LA0716基因组上。蓝色箭头,SpDIR1L ORF;白色矩形,预测转录本;del,来自Esculentum和Arcanum物种的缺失。(b) DIR1L蛋白的积累。Slyc = S. lycopersicum, Sgal = S. galapagense, Sche = S. cheesmaniae, Spim = S. pimpinellifolium, Sneo = S. neorickii, Schm = S. chmielewskii, Sarc = S. arcanum, Scor = S. corneliomulleri, Schi = S. chilense, Shab = S. habrochaites, Spen = S. pennellii, Ssit = S. sitiens.
结论
作者的研究工作鉴定出了番茄进化枝中S-Rnase独立的IRBs屏障基因—SpDIR1L。前人研究结果表明SC S. pennellii LA0716 S-Rnase中独立IRBs还需要HT蛋白的帮助[9],基于此,作者认为SpDIR1L和HT-A之间的上位性可以在未来番茄植株功能获得实验中检测,除了HT依赖的IRB外,SC S. pennellii LA0716还包含另一种不关联的IRB机制,所以SpDIR1L上位性可能与一种尚不清楚的因素有关,DIR1L依赖的花粉排斥机制也有待进一步研究。
参考文献
1.Barton, N.H. The role of hybridization in evolution. Mol. Ecol. 2001, 10, 551–568.
2.Abbott, R.; Albach, D.; Ansell, S.; Arntzen, J.W.; Baird, S.J.E.; Bierne, N.; Boughman, J.; Brelsford, A.; Buerkle, C.A.; Buggs, R.; et al. Hybridization and speciation. J. Evol. Biol.2013, 26, 229–246.
3.Broz, A.K.; Bedinger, P.A. Pollen-Pistil Interactions as Reproductive Barriers. Annu. Rev. Plant Biol. 2021, 72, 615–639.
4.Bedinger, P.A.; Broz, A.K.; Tovar-Mendez, A.; McClure, B. Pollen-pistil interactions and their role inmate selection. Plant Physiol. 2017, 173, 79–90.
5.Tovar-Mendez, A.; Kumar, A.; Kondo, K.; Ashford, A.; Baek, Y.S.; Welch, L.; Bedinger, P.A.; McClure, B.A. Restoring pistil-side self-incompatibility factors recapitulates an interspecific reproductive barrier between tomato species. Plant J. 2014, 77, 727–736.
6.Chalivendra, S.C.; Lopez-Casado, G.; Kumar, A.; Kassenbrock, A.R.; Royer, S.; Tovar-Mendez, A.; Covey, P.A.; Dempsey, L.A.; Randle, A.M.; Stack, S.M.; et al. Developmental onset of reproductive barriers and associated proteome changes in stigma/styles of Solanum pennellii. J. Exp. Bot. 2013, 64, 265–279.
7.Peralta, I.E.; Spooner, D.M.; Knapp, S. Taxonomy of wild tomatoes and their relatives (Solanum sect. Lycopersicoides, sect. Juglandifolia, sect. Lycopersicon; Solanaceae). Syst. Bot. Monogr. 2008, 84, 1–186.
8.Nakazato, T.; Warren, D.L.; Moyle, L.C. Ecological and geographic modes of species divergence in wild tomatoes. Am. J. Bot. 2010, 97, 680–693.
9.Pease, J.B.; Haak, D.C.; Hahn, M.W.; Moyle, L.C. Phylogenomics reveals three sources of adaptive variation during a rapid radiation. PLoS Biol. 2016, 14, e1002379.
10.Tovar-Mendez, A.; Lu, L.; McClure, B. HT proteins contribute to S-RNase-independent pollen rejection in Solanum. Plant J.2017, 89, 718–729.


特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。