|
|
|
|
|
中科院南海海洋研究所鞠建华团队:Kendomycin B生物合成基因簇的鉴定及异源表达 | MDPI Marine Drugs |
|
|
论文标题:Identification and Heterologous Expression of the Kendomycin B Biosynthetic Gene Cluster from Verrucosispora sp. SCSIO 07399(Kendomycin B生物合成基因簇的鉴定及异源表达)
期刊:Marine Drugs
作者:Jiang Chen, Shanwen Zhang, Yingying Chen, Xinpeng Tian, Yucheng Gu and Jianhua Ju
发表时间:26 November 2021
DOI:10.3390/md19120673
微信链接:
https://mp.weixin.qq.com/s?__biz=MzI1MzEzNjgxMQ==&mid=2650048613&idx=2&sn=
9c712a9d0c618e6b2c43b750b00a6606&chksm=f1d932a1c6aebbb71019c7a9e408b6ac
c33e7c5939170c549d9ee7abad616c158705633c3d28&token=1910072809&lang=zh_CN#rd
期刊链接:
https://www.mdpi.com/journal/marinedrugs
原文作者简介

通讯作者
鞠建华,博士生导师,中国科学院南海海洋研究所研究员。主要从事海洋微生物活性次级代谢产物的发现、生物合成和抗感染、抗肿瘤创新药物研发工作。

第一作者
陈姜,中国科学院大学,中国科学院南海海洋研究所直博生,主要从事海洋来源放线菌的活性次级代谢产物的生物合成机制研究。
前言
Kendomycins是安莎霉素类聚酮化合物,具有特殊的全碳环ansa骨架,一个高度取代的吡喃环偶联一个醌发色团。此类化合物具有多样的生物活性,包括抗菌、抗骨质疏松和抗肿瘤等。活性机制研究亦表明其具有多效性,例如调节阳离子和抑制蛋白酶体等。Kendomycins结构的特殊性和活性的优越性引起了研究者们广泛关注,其化学全合成过程和可能的生物合成途径被相继报导,但对于其全碳环ansa骨架的天然形成机制及参与催化的酶系至今仍未可知,值得深入探究。
本课题组在之前的研究中从一株深海疣孢菌Verrucosispora sp. SCSIO 07399中分离获得了三个新安莎霉素类化合物kendomycin B-D,其中kendomycin B为真正的天然产物,而kendomycin C和D则是kendomycin B的C20位巯基取代衍生物。本次研究则鉴定了kendomyicin B的生物合成基因簇 (kmy),并进行了异源表达;推测了kendomyicin B可能的生物合成途径,并鉴定其起始单元为3,5-二羟基苯甲酸 (3,5-DHBA);同时鉴定了一个正调控基因kmy4,并探究了其正调控效应。
实验结果
鉴定kendomycin B的生物合成基因簇及其边界
通过全基因组测序和生物信息学分析,我们找到了kendomyicin B可能的生物合成基因簇 (kmy)——I型/III型PKS (polyketide synthase,聚酮合酶) 杂合基因簇。与前人所报导的基因簇 (ken) 比对发现,kmy基因簇中缺少一个甲基转移酶基因,这与kendomycin B结构中缺少一个甲基是相吻合的;此外,kmy基因簇还包含额外的三个转座酶基因 (kmy1-3) 和一组甲基丙二酰-CoA合成相关基因 (kmy22-25),但对其进行敲除后并不影响kendomycin类化合物的生产,表明其并非必须的生物合成基因。通过系统的基因敲除确定了kmy基因簇的功能并鉴定其上下游边界分别为kmy4和kmy29 (图1)。

图1. 生物合成基因簇比对。kmy:本研究中kendomycin B生物合成基因簇;ken:前人报导的kendomyicin生物合成基因簇。
起始单元鉴定及kendomyicin B生物合成途径推测
通过基因敲除和化学回补实验确证3,5-二羟基苯甲酸 (3,5-DHBA) 为kendomyicn B真正的生物合成起始单元 (图2)。且基于前人的研究和生物信息学分析结果,我们推测了kendomyicin B可能的生物合成途径:III型PKS负责起始单元的合成,I型PKS负责聚酮链的延伸,NAD(P)依赖的氧化还原酶Kmy5、FAD依赖的氧化还原酶Kmy9和FAD依赖的单加氧酶Kmy13可能负责后修饰过程中ansa骨架的形成 (图3)。

图2. 起始单元化学回补实验。△kmy18:III型PKS基因突变株;Wild type:野生型菌株SCSIO 07399。

图3. Kendomyicin B可能的生物合成途径。
进化树分析将Kmy4归属为LuxR正调控基因kmy4的功能探究家族的LAL型调控蛋白,RT-qPCR (real-time quantitative PCR,实时荧光定量PCR) 比较kmy4基因突变株与野生型菌株中kmy基因簇中基因的转录水平,结果显示突变株△kmy4中kmy基因的转录水平大大降低,表明Kmy4对其具有较强的调控激活作用,证实了其正调控功能 (图4)。

图4. △kmy4基因突变株中kendomycin B合成相关基因的表达变化。
Kendomyicn B基因簇的异源表达
通过BAC (bacterial artificial chromosome) 文库的构建和筛选,获得了携带完整kmy基因簇的质粒pHZAUFXJ-3-J11,并利用“三亲本”接合转移技术实现了kmy基因簇的异源表达 (图5)。
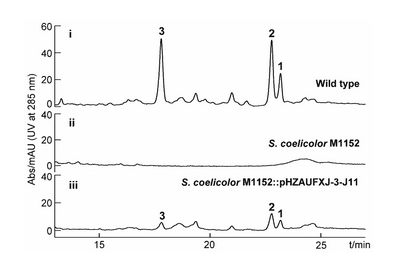
图5. 异源表达HPLC分析结果。Wild type:野生型菌株SCSIO 07399;S. coelicolor M1152:异源表达宿主菌;S. coelicolor M1152::pHZAUFXJ-3-J11:kmy基因簇异源表达重组菌株。
结论
本研究鉴定了kendomyicin B的生物合成基因簇 (kmy),并通过PKS基因敲除和异源表达实验确证了其功能。系统的基因敲除不仅确定了基因簇的边界还发现了一个正调控基因kmy4,并通过RT-qPCR证实了Kmy4的正调控功能。此外,本研究还推测了kendomyicin B可能的生物合成途径,并通过化学回补实验证明了3,5-二羟基苯甲酸为聚酮链的起始单元。我们推测一组氧化还原酶 (Kmy5、Kmy9和Kmy13) 很有可能参与催化复杂的后修饰环化过程,后续我们将对其进行实验验证以期阐明kendomycin B完整的生物合成途径,并为运用组合生物合成技术的结构改造和活性优化奠定基础。
Marine Drugs 期刊介绍
主编:Orazio Taglialatela-Scafati, University of Naples Federico II, Italy
主题涵盖所有来自海洋活性物质的研究,涉及其发现、鉴定及各方面的应用。
2020 Impact Factor:5.118
2020 CiteScore:6.4
Time to First Decision:11.7 Days
Time to Publication:30 Days
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。