
论文截图
学习压力大,工作强度高,长期焦虑让人“吃不好”、“睡不好”!近年来,科学家们研究发现慢性压力下造成的焦虑、抑郁等负面情绪,会进一步导致代谢失衡现象,然而其内在的神经机制并不明确。
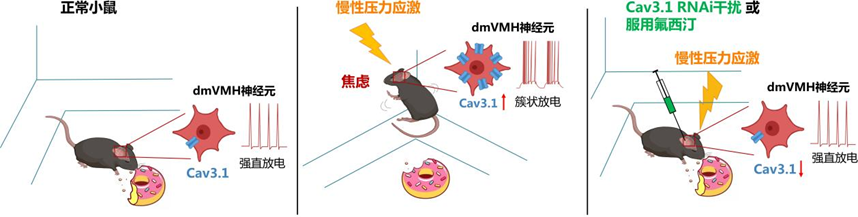
3月22日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所、深港脑科学创新研究院杨帆课题组在Nature旗下神经科学领域著名期刊Molecular Psychiatry《分子精神病学》发表最新研究成果。研究团队发现慢性压力应激下,大脑中下丘脑腹内侧核(Ventromedial hypothalamus, VMH)神经元的簇状放电参与了焦虑与能量代谢的调控作用。
该研究成果不仅深入解析了压力应激导致焦虑与代谢异常的神经机制,也为干预焦虑应激等相关疾病提供新的干预策略。深圳先进院杨帆研究员为论文的独立通讯作者,深圳先进院邵杰博士、博士生高大双与副研究员刘运辉为共同第一作者,深圳先进院为论文第一单位。
神经元会“放电”
随着生活节奏的加快,几乎每个人都会经历不同程度的焦虑,而长期处于这种焦虑情绪不仅会影响心理健康,通常也会引起食欲下降、内分泌紊乱、代谢异常等生理问题。
为什么焦虑的人会食欲下降,从而导致代谢异常?其内在神经机制是如何?这要从一类会“簇状放电”的神经元说起。
研究首先发现,长期处于压力应激下的小鼠,出现了焦虑行为,焦虑的小鼠表现出了摄食减少,能量消耗降低的现象。与此同时,其大脑中的一类下丘脑腹内侧核团(VMH)中的簇状放电神经元的比例和强度也显著上升。
通过光遗传技术对这类VMH神经元进行调控,可持续诱发簇状放电,并进一步诱发了小鼠的焦虑样行为和代谢变化。这表明簇状放电的改变,是慢性压力应激下VMH神经元调控焦虑与外周代谢的重要机制。
“在大脑网络中,信号的传递需要通过神经元的‘放电行为’,对信号进行处理和传递,簇状放电是VMH神经元的特性,是神经元短时间内连续、高频的放电行为,这种放电行为的异常会产生不同的功能障碍。”邵杰解释道。
抑制“放电” 缓解焦虑
既然VMH神经元的簇状放电行为会导致焦虑,并进一步导致代谢异常,那么抑制这种“放电行为”,是否能够进一步缓解焦虑和代谢异常的现象?
为进一步验证VMH神经元簇状放电的功能,研究团队首先在离体电生理实验中,运用抑制钙离子通道的阻滞剂——米贝拉地尔可,发现该药能够抑制VMH神经元的簇状放电,而对慢性压力应激小鼠模型进行套管给药,则可以缓解焦虑行为和代谢改变。
“离子通道就像‘开关’一样,它决定着神经元的放电行为。我们发现钙离子通道Cav3.1在VMH神经元的调控中扮演了重要角色。”邵杰表示,通过干扰VMH核团中相关离子通道的表达,可直接造成焦虑小鼠VMH中簇状放电神经元的减少,以及自发钙信号的减弱,焦虑样行为及相关代谢改变也得到一定程度的缓解。
在临床治疗中,氟西汀是一种用于抑郁症和焦虑症的治疗的常见药物。研究团队通过对慢性压力应激小鼠模型施以四周的氟西汀,以阻断慢性压力应激诱发的焦虑情绪,同对照组相比VMH核团簇状放电神经元比例下降,小鼠的外周代谢水平和焦虑样行为也得到了缓解,提示VMH的簇状放电神经元也是氟西汀的潜在作用靶点。
VMH神经元簇状放电调控焦虑样行为及能量代谢 科研团队供图
此前,杨帆团队解析出了一条慢性压力应激引发焦虑和骨丢失的神经环路(JCI, 2020),其中VMH神经元担任了传递“焦虑信号”的重要角色。“在此项研究中,我们进一步发现VMH核团中的簇状放电神经元在调控慢性压力应激诱导的焦虑样行为及代谢改变中扮演了重要作用,研究发现的钙离子通道Cav3.1也为临床干预焦虑症、抑郁症等相关疾病提供了潜在靶点。”杨帆表示。
长期慢性压力应激导致的焦虑情绪会进一步诱发代谢异常等现象,而机体代谢稳态的打破会造成肥胖、骨质疏松、高血脂等一系列代谢疾病。杨帆表示,长期压力下导致的焦虑情绪更需要引起关注,日常生活中避免长期处于压力大的环境,保持心情愉悦,适当运动,听音乐,冥想等方式都有助于脑区神经元的正常工作,为大脑“松绑”,缓解焦虑情绪。(来源:中国科学报 刁雯蕙)
相关论文信息:https://doi.org/10.1038/s41380-022-01513-x
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:
[email protected]。