2022年7月11日,国际顶尖学术期刊Nature Materials在线发表了西安交通大学、芬兰图库大学、美国明尼苏达大学、华盛顿大学圣路易斯分校、南京航空航天大学等单位联合研究团队题为“Directed cell migration toward softer environments”的研究成果。
研究团队发现了U-251MG神经胶质瘤细胞与神经细胞轴突末端生长锥具有明显的“负趋硬性(Negative durotaxis)”行为,揭示了不同种类细胞感知及响应细胞外基质力学特性差异的力学生物学机制。
西安交通大学生命学院仿生工程与生物力学研究所助理教授程波为论文共同第一作者,西安交通大学林敏教授、芬兰图库大学Johanna Ivaska教授、美国明尼苏达大学Mark Distefano教授和David Odde教授为论文通讯作者。
生物体内的细胞始终受到多种形式的力学刺激(如细胞外基质力学特性、流体剪切力及基质拉伸等)。细胞可通过感知这些力学刺激,并将力学刺激信号转导为生化信号,进而激活细胞内一系列应答反应,最终影响细胞分化、迁移等功能。细胞外基质力学特性(如刚度梯度)在生物体的生长发育及疾病的发生发展过程中扮演着重要角色。例如,在癌症发生发展过程中,病变组织的纤维化导致细胞外基质刚度梯度发生改变,进而影响癌细胞的侵袭行为;在神经系统生长、发育和再生过程中,基质的刚度梯度是神经细胞轴突趋向性生长的主要驱动力。因此,研究细胞如何响应基质刚度梯度及其潜在的分子机制是当前生物学、生物医学及生物力学领域迫切需要解决的科学问题之一。
大量研究已经证实,在刚度梯度基质上培养的细胞(比如成纤维细胞、乳腺癌细胞),倾向于朝向硬基质迁移,通常称之为“趋硬性(Durotaxis)”。近日,西安交通大学、芬兰图库大学、美国明尼苏达大学、华盛顿大学圣路易斯分校、南京航空航天大学等单位合作,发现U-251MG神经胶质瘤细胞与神经细胞轴突末端生长锥具有明显的“负趋硬性(Negative durotaxis)”行为(图1)。研究团队发现:针对相关关键蛋白的分子生物学实验结果难以揭示上述反常的细胞迁移现象。为此,研究团队基于力学平衡原理,建立了基于整合素(integrin)黏附强化效应的细胞迁移力学模型,提出了整合素受力过程中,迫使连接在其上并处于折叠状态的踝蛋白(talin)结构域被打开,进而募集纽蛋白(vinculin),实现力敏感的黏附强化过程,并最终导致细胞的“趋硬性”迁移;而力敏感黏附强化效应的缺失,则导致细胞的“负趋硬性”迁移。上述力学模型的预测结果得到了实验验证:通过踝蛋白的敲低实验使得具有“趋硬性”迁移行为的乳腺癌细胞产生“负趋硬性”迁移现象。

图1:细胞“负趋硬性”(Negative-durotaxis)迁移现象。(A-B)实验观察表明胶质瘤细胞倾向于向较软基质迁移;(C-E)建立基于整合素黏附强化效应的细胞迁移力学模型并对实验结果进行重现,揭示踝蛋白力致构象变化介导整合素黏附强化效的缺失在细胞“负趋硬性”迁移中起到关键作用;(F)通过实验敲低踝蛋白对理论模型进行验证。
该研究从踝蛋白力致构象变化介导整合素黏附强化效的应角度为癌细胞“趋硬性”与“负趋硬性”迁移机制提供了统一的理论解释(图2)。该研究工作揭示了不同种类细胞感知及响应细胞外基质力学特性差异的分子机制,为探究疾病的发生发展机制提供理论依据。
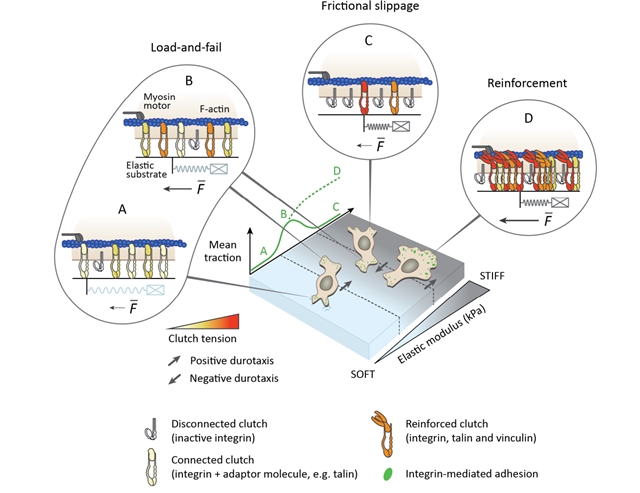
图2:基于黏附强化(缺失)效应细胞“趋硬性”与“负趋硬性”迁移的生物力学机制。
该研究也得到了南京航空航天大学卢天健教授、西安交通大学徐峰教授及华盛顿大学圣路易斯分校Guy Genin教授等的大力协助。该项工作获得了国家自然科学基金、陕西省青年拔尖人才支持计划和西安交大青年拔尖人才支持计划等资助。
林敏教授课题组围绕细胞力敏感受体介导细胞功能调控的力学生物学机制这一科学问题,通过细胞力学微环境构建、表征,结合力学模型与细胞生物学实验,开展了系列研究,在细胞生物力学领域开展了原创性工作,代表性研究成果发表在《自然-材料》(Nature Materials,2022)、《自然-通讯》(Nature Communications,2021)、《科学进展》(Science Advances,2020)等权威期刊上。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41563-022-01294-2