中国科学院上海药物研究所研究员李亚平团队构建了一种基于肿瘤细胞膜囊泡的个性化纳米疫苗,实现了控制肿瘤生长的功能,并揭示了B细胞作为调节靶点的重要潜力,为设计靶向B细胞的肿瘤疫苗提供了参考。12月23日,相关研究发表于《先进材料》。
B细胞既可以分泌肿瘤特异性抗体,也可以向T细胞提呈抗原,同时参与抗肿瘤细胞免疫和体液免疫。B细胞受体更敏感、更强大的抗原识别能力,则为开发针对B细胞的肿瘤疫苗提供了依据。基于单一组分抗原的疫苗难以对抗异质性肿瘤,保留了多价抗原的肿瘤细胞膜是良好的抗原供体,然而,细胞膜衍生的肿瘤疫苗免疫原性弱,需要加以改良才能有效克服肿瘤免疫耐受问题。
基于此,研究团队通过在肿瘤细胞膜囊泡上使用小分子交联剂偶联两种免疫增强剂,即激动性CD40抗体(aCD40)和CpG,制备了一种靶向B细胞的个性化多表位肿瘤纳米疫苗CM-CpG-aCD40。该疫苗可主动靶向并蓄积在外周免疫器官,通过肿瘤细胞膜上的抗原与B细胞受体结合、aCD40与CD40结合、CpG与Toll样受体9结合,为B细胞提供多重活化信号,促进B细胞的抗体分泌和抗原呈递。CM-CpG-aCD40还能促进树突状细胞熟化,从而激活CD8+T细胞,并重编程肿瘤相关巨噬细胞至M1表型。在三阴性乳腺癌小鼠模型中,该疫苗达到了89.3%的肿瘤生长抑制率。
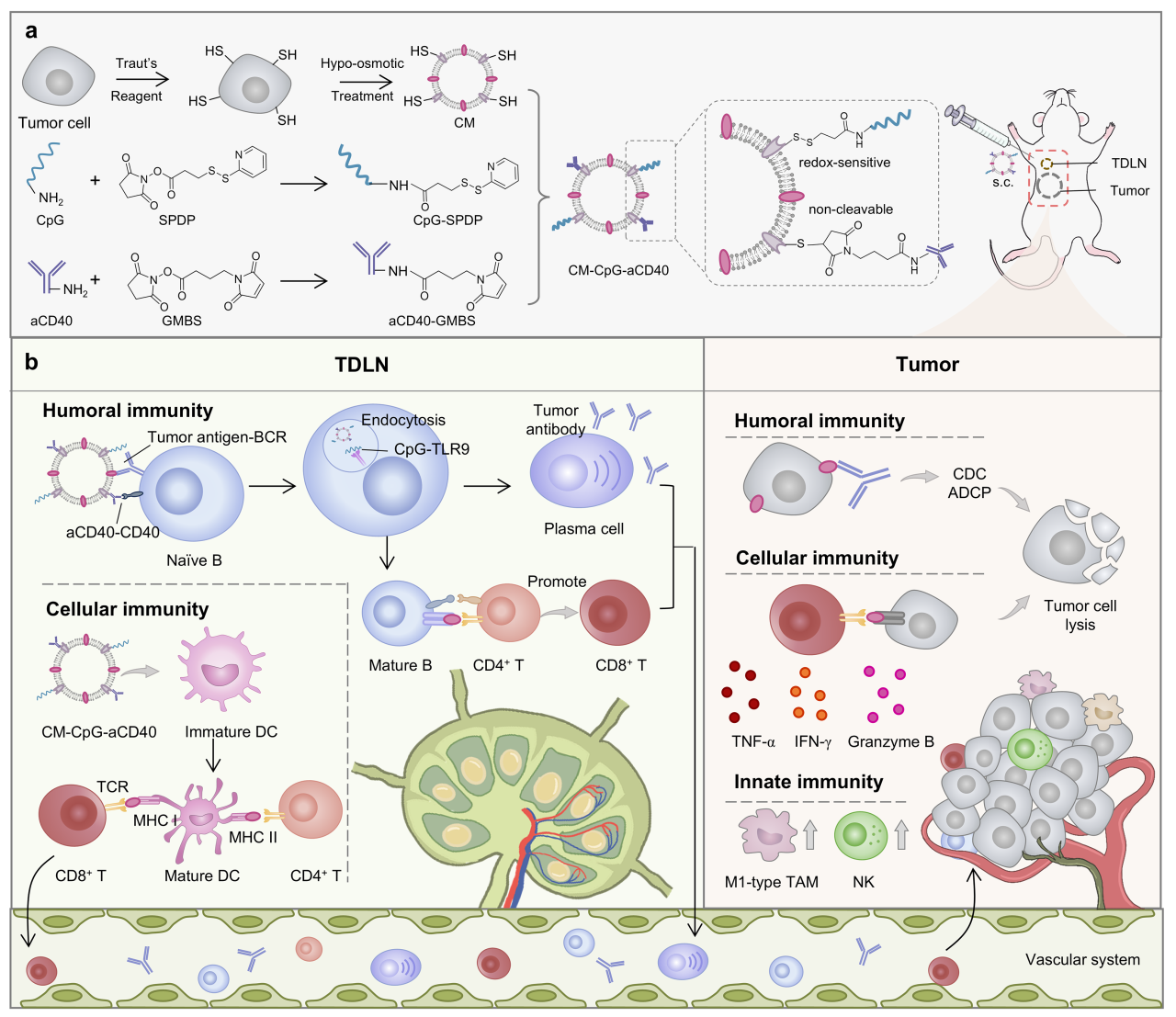 多表位个性化肿瘤疫苗CM-CpG-aCD40的制备和功能。图片来源于《先进材料》
多表位个性化肿瘤疫苗CM-CpG-aCD40的制备和功能。图片来源于《先进材料》
?
相关论文信息:https://doi.org/10.1002/adma.202411361
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:
[email protected]。