|
|
|
|
|
海南大学与自然资源部第三海洋研究所合作——海洋含卤脂肪酸及其类似物的全合成和抗炎活性 | MDPI Marine Drugs |
|
|
论文标题:Total Synthesis and Anti-Inflammatory Bioactivity of (−)-Majusculoic Acid and Its Derivatives(红景天总合成及抗炎活性研究(−)-主果酸及其衍生物)
期刊:Marine Drugs
作者:Hong-Xiu Xiao, Qing-Xiang Yan ,Zhi-Hui He, Zheng-Biao Zou, Qing-Qing Le, Ting-Ting Chen, Bing Cai, Xian-Wen Yang and Su-Lan Luo
发表时间:21 May 2021
DOI:10.3390/md19060288
微信链接:
https://mp.weixin.qq.com/s/kJcpgAiuOTGUNm9vExjFeQ
期刊链接:
https://www.mdpi.com/journal/marinedrugs
原文通讯作者简介

杨献文,自然资源部第三海洋研究所研究员,博士生导师。主要从事海洋微生物天然产物研究,目前聚焦海洋真菌,尤其是深海生物共附生真菌,从中寻找发现结构新颖及活性显著的次级代谢产物。

肖宏秀,海南大学、自然资源部第三海洋研究所和厦门大学联合培养硕士研究生。主要从事天然产物的结构修饰及其相关生物活性研究。
引言
(−)-Majusculoic acid (1) 是在2005年由加州大学Davis分校的Molinski课题组从巴哈马群岛南部的珊瑚礁上的蓝藻中首次提取分离得到的长链脂肪酸化合物[1]。厦门大学张延东教授课题组在2018年发展了利用皇冠结构的十四圆环内酯实现构象控制的环丙烷化反应,利用“二聚-环丙烷化-解聚”的策略,实现了两个手性中心的构建,以及发展了构建溴代共轭双烯的方法,最终实现(+)-majusculoic acid (1) 的全合成,确定了该天然产物的绝对构型[2]。
近期,海南大学热带生物资源教育部重点实验室罗素兰教授团队与自然资源部第三海洋研究所海洋生物资源遗传重点实验室杨献文教授团队合作构建了更加简洁的路线,实现了海洋天然产物(−)-majusculoic acid (1) 及其七种类似物(9–15) 的首次全合成,并且探究了其抗炎活性的构效关系。

合成的(−)-majusculoic acid及其类似物。
实验过程
1. (−)-Majusculoic acid (1) 的全合成策略
其该项工作从商业可得廉价的(S)-(+)-环氧氯丙烷 (16) 出发通过三步反应快速构建了反式环丙烷结构,再通过还原反应、Wittig反应、臭氧化等反应通过五步实现增碳操作,之后利用HWE反应实现了溴代共轭二烯的快速构建[2],十步的总产率是3%。

(−)-Majusculoic acid的全合成路线。
2. (−)-Majusculoic acid (1) 的类似物全合成策略
采用(−)-majusculoic acid (1) 全合成路线的中间产物19,利用HWE反应实现碳链缩短的类似物的构建。

(−)-Majusculoic acid的碳链缩短类似物的合成。
在常压条件下,氢气二氧化铂和氢气钯碳不能直接对环丙烷开环,因此该项工作通过油酸甲酯臭氧化得到的醛27来构建环丙烷缺失的类似物14和15。

(-)-Majusculoic acid的环丙烷缺失类似物的合成。
利用不含溴的HWE试剂可以实现不含溴原子的(-)-majusculoic acid类似物的合成。

(−)-Majusculoic acid的溴原子缺失类似物的合成。
3. HWE试剂的合成策略
采用文献方法[2],从炔醇S1出发,由Red-Al还原炔烃,再由NBS溴代得到溴代烯烃一级醇。利用三苯基膦和四溴化碳的作用,可以将溴代烯烃一级醇转化生成二溴化合物S3。二溴取代的烯烃S3可以用于制备Horner试剂,在氢化钠作用下,和亚磷酸三甲酯或者是亚磷酸三乙酯反应,分别生成Horner试剂S4和S5。针对不含溴原子的Horner试剂的合成,本研究也采用了2-己烯-1-醇(S6)作为原料,通过三溴化磷发生一个溴代反应,然后和三甲氧基磷在130摄氏度下,生成不含有溴原子的Horner试剂。

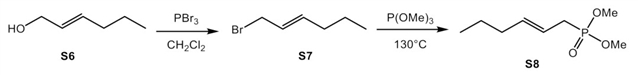
HWE试剂的合成[2]。
4. 构效关系
本文也通过测定脂多糖 (LPS) 诱导的小鼠巨噬细胞RAW264.7中一氧化氮 (NO) 的产生来评估八个化合物 (1, 9–15) 的潜在抗炎活性。结果显示(−)-majusculoic acid (1), methyl majusculoate (9), 和 (1R,2R)-2-((3E,5Z)-6-bromonona-3,5-dien-1-yl)cyclopropane-1-acid (12) 显示出抗炎的效果,抑制率分别为33.68%、35.75%和43.01%。初步的构效关系研究表明,碳链长度会影响抗炎活性,酯化反应对脂肪酸的抗炎活性没有影响,反式环丙烷结构和溴原子对抗炎活性的保持具有关键作用。此外,它们对RAW264.7细胞没有显示细胞毒性,表明它们可能是潜在的抗炎化合物。

(−)-Majusculoic acid及其类似物抗炎活性的构效关系。
结论
该项工作实现了海洋天然产物(−)-majusculoic acid (1) 及其七种类似物(9–15) 的首次全合成。总的来说,以三至十步的反应,产率为3%至28%实现了天然产物和类似物的全合成。该策略的特点:第一点是立体选择性得高效合成反式环丙烷结构,第二点是应用溴烯烃化方法,通过Horner-Wadsworth-Emmons (HWE) 反应进行立体选择性得共轭烯烃的构建。本文也通过测定脂多糖 (LPS) 诱导的小鼠巨噬细胞RAW264.7中一氧化氮 (NO) 的产生来评估八种化合物 (1, 9-15) 的潜在抗炎活性。结果显示(−)-majusculoic acid (1), methyl majusculoate (9), 和 (1R,2R)-2-((3E,5Z)-6-bromonona-3,5-dien-1-yl)cyclopropane-1-acid (12) 显示出抗炎的效果,抑制率分别为33.68%、35.75%和43.01%。此外,它们对RAW264.7细胞没有显示细胞毒性,表明它们可能是潜在的抗炎剂。
该研究成果以“Total Synthesis and Anti-Inflammatory Bioactivity of (−)-Majusculoic Acid and Its Derivatives”为题,发表于化学药物类期刊Marine Drugs (DOI: 10.3390/md19060288)。硕士研究生肖宏秀女士为第一作者,杨献文教授与罗素兰教授为共同通讯作者,研究工作得到了国家自然科学基金的支持(21877022)。原文作者特别感谢厦门大学化学化工学院张延东教授以及陈仁治博士对本研究工作给予的建设性意见和讨论。
期刊简介
Marine Drugs (ISSN 1660-3397; IF 5.118) 是国际型开放获取期刊之一,主题涵盖所有来自海洋活性物质的研究,涉及其发现、鉴定及各方面的应用。Marine Drugs目前已被SCIE、Scopus等重要数据库收录。期刊采取单盲同行评审,一审周期约为11.7天,文章从接收到发表平均处理时间仅需2.8天。


特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。