|
|
|
|
|
铜催化的立体汇聚式不对称Michaelis–Becker交叉偶联反应 |
|
|
2023年2月23日,南方科技大学刘心元教授团队在Nature Synthesis期刊上发表了一篇题为“A general copper-catalysed enantioconvergent radical Michaelis–Becker-type C(sp3)–P cross-coupling”的研究成果。
课题组成功实现了外消旋烷基卤代物与亚磷酸酯的立体汇聚式不对称Michaelis–Becker交叉偶联反应。论文通讯作者是刘心元;共同第一作者是王立磊、周焕、曹予曦。
α-手性的烷基膦化合物是有机合成中重要的分子砌块,也是在活性分子、农药以及材料中得到广泛应用的关键功能单元(图1a)。因此发展不对称催化的构建手性C(sp3)–P键的方法是十分重要的。Michaelis–Becker反应最早在19世纪末被发现,迄今为止已被应用长达一个多世纪,是最有效的快速构建C(sp3)–P键的方法之一。然而,由于其立体专一的SN2机理特点,该方法始终无法被用于构建手性的C(sp3)–P键(图1b)。近年来,随着3d过渡金属催化的发展,实现这类反应的不对称转化迎来了契机。3d过渡金属可以通过单电子还原将外消旋的烷基卤代物转化为潜手性的烷基自由基物种,通过这种反应机理,可以实现立体汇聚式的不对称Michaelis–Becker反应(图1c)。然而,实现这一反应依旧面临着背景反应强、催化剂毒化、反应启动困难以及存在P-P偶联的副反应等难题。

图1:反应的背景和设计
刘心元教授团队一直以来致力于发展铜催化的不对称自由基反应,他们在先前的工作中发现手性阴离子配体可以提高一价铜的还原性,从而可以将外消旋的烷基卤代物还原为潜手性的烷基自由基。在这样一种催化体系下,该团队已经实现了一系列立体汇聚式的自由基C(sp3)–C/N交叉偶联反应(J. Am. Chem. Soc. 2022, 144, 17319; Nat. Chem. 2019, 11, 1158; J. Am. Chem. Soc. 2021, 143, 15413; Nat. Chem. 2022, 14, 949; etc.)。
在前期工作的基础上,刘心元团队成功克服了上述难题,发展了一类铜催化的立体汇聚式不对称Michaelis–Becker交叉偶联反应(图1d)。作者首先对背景反应进行测试,找到合适的可以抑制背景反应的溶剂。接着作者通过对配体筛选发现金鸡纳碱骨架的N,N,P配体可以有效提高反应的产率和对映选择性,经过对配体进一步的改造以及铜催化剂、温度等反应参数的优化,最终能以较高产率和对映选择性得到目标产物(图2)。反应能很好地兼容苄基、炔丙基以及羰基α位卤代物(图 3-4)。产物可以经过简单转化得到多种多样的手性含磷砌块和先导药物,充分说明了这一方法的实用性(图5)。机理实验可以充分佐证作者提出的机理设想。
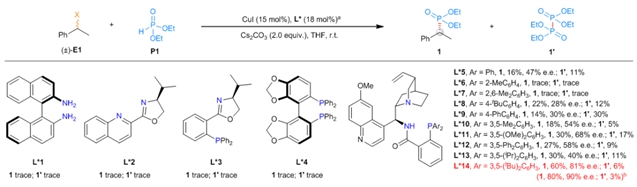
图2:配体对反应的影响

图3:苄基卤代物底物适用范围

图4:炔丙位以及羰基α位底物适用范围

图5:反应适用性和机理研究
该项目得到了国家自然科学基金委员会、科技部、广东省科技厅、深圳市科创委等项目的大力资助。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s44160-023-00252-3